20.02.2025 9-Г Горіння вуглеводнів
Домашнє завдання § 22, виконати вправу 171,172.
12.01.2023 9-д,г Окисно- відновні реакції
13.01.2023 9- а,в
Окисно-відновними реакціями називаються хімічні реакції, які протікають зі зміною ступенів окиснення атомів хімічних елементів або йонів, що утворюють реагуючі речовини.
- записати схему реакції;
- вказати ступені окиснення і визначити елементи, які змінюють ступінь окиснення;
- скласти рівняння процесів окиснення і відновлення;
- зрівняти число приєднаних та відданих електронів, ввівши множники, використавши найменше спільне кратне;
- підставити знайдені коефіцієнти перед формулами речовин, що містять ці частинки;
- розставити коефіцієнти перед формулами інших речовин методом підбору;
- перевірити правильність розстановки коефіцієнтів.
2H+12S−2+3O02→2S+4O−22+2H+12O−2 S−2−6е−→S+4O02+4e−→2O−2∣∣∣∣Н.С.К12∣∣∣∣Коеф.23∣∣∣∣окиснюється,відновниквідновлюється,окисник
Опрацювати § 15,16 виконати вправу 118 ст. 88
5.12.2022 9-б,д Аналіз контрольної роботи, робота над помилками.
2.12.2022 9-а,в Контрольна робота
1.12.2022 9-г,д Контрольна робота
29.11.2022 9-б Контрольна робота.
29.11.2022 9-а,г,в
28.11.2022 9-д,б
26.11.2022 9-а,в асинхронний урок
24.11.2022 9-д Ступінь окиснення. Складання формул бінарних сполук за відомими ступенями окиснення елементів.
У нейтральній частинці (наприклад, у молекулі), сума ступенів окиснення атомів дорівнює
25.11.2022 9-а,в
24.11.2022 9-г
22.11.2022 9-б
21.11.2022 9-д
Класифікація хімічних реакцій
- реакцій сполучення:
2H2+O2=2H2O ; - реакції розкладу:
CaCO3=t°CaO+CO2↑⏐⏐ ; - реакції заміщення:
Zn+H2SO4=ZnSO4+H2↑ ; - реакції обміну:
Na2SO4+BaCl2=2NaCl+BaSO4↓ . - окисно-відновні реакції:
S0+O20=S+4O2−2 ; - реакції йонного обміну:
Ag++Cl−=AgCl⏐↓ . - екзотермічні реакції:
CH4+2O2=CO2↑+H2O+Q ; - ендотермічні реакції:
BaCO3=BaO+CO2↑−Q . - оборотні реакції:
Ca(OH)2⇄CaO+H2O ; - необоротні реакції:
H2SO4+2NaOH=Na2SO4+2H2O
19.11.2022 9-г, д
18.11.2022 9-а,в
17.11.2022 9-д,г
15.11.2022 9-б Практична робота №2 ,, Розв'язування експериментальних задач''
15.11.2022 9-а,в,г
14.11.2022 9-д,б Практична робота №1 ,, Реакції йонного обміну між електролітами у водних розчинах.''
11.11.2022 9-а, в
10.11.2022 9-г, д
08.11.2022 9-б Якісні реакції на деякі йони. Лабораторні досліди 7-9.
Хімічні реакції, що супроводжуються особливими зовнішніми ефектами (утворення характерного осаду, виділення газу з певними властивостями, поява чи зміна забарвлення розчину) називають якісними.
Лабораторний дослід №7 Виявлення хлорид-йонів.
а) взаємодія натрій хлориду з аргентум нітратом
https://www.youtube.com/watch?v=-697j9U5Q1A
б) взаємодія хлоридної кислоти з аргентум нітратом
https://www.youtube.com/watch?v=ga-D87rRdQw
Лабораторний дослід №8 Виявлення сульфат-йонів у розчині
https://www.youtube.com/watch?v=cIHA9PXdgVw
Лабораторний дослід№9 Виявлення карбонат - йонів у розчині.
а) взаємодія крейди з хлоридною кислотою (лаб. дослід 5б)
б) взаємодія кальцинованої соди з хлоридною кислотою
https://www.youtube.com/watch?v=4cmmA4s_vAE
в)взаємодія питної соди з хлоридною кислотою (ознакою реакції є виділення газу)
Домашнє завдання Опрацювати §12, оформити лабораторні досліди №7-9
08.11.2022 9-а,в,г
07.11.2022 9-б, д Реакції йонного обміну. Лабораторні досліди 4-6 ,,Реакції обміну в розчинах електролітів''
Лабораторний дослід №4 з випаданням осаду;
а) взаємодія купрум (ІІ) сульфату з натрій гідроксидом - утворення синього осаду
Домашнє завдання. Повторити § 10,11 оформити лабораторні досліди 4-6 в зашиті для лабораторних та практичних робіт.
29.10.2022 Пройти контрольне тестування всім обов'язково за покликанням
9-А https://vseosvita.ua/test/start/gra298
9-Б https://vseosvita.ua/test/start/eyo392
9-В https://vseosvita.ua/test/start/rve873
28.10.2022 9-а,в
27.10.2022 9-г,д
25.11.2022
Тренувальні вправи. Реакції йонного обміну. Складання молекулярних рівнянь за скороченим йонним рівнянням.
Повторити тему можна переглянувши відеоурок.
https://www.youtube.com/watch?v=lp6K5nKo6bc
https://jamboard.google.com/d/10spB-l1XgS1yfhyFhCUnY5YubXne433wV_gSPtUbu6Y/edit?usp=sharing
Домашнє завдання Повторити § 10, виконати вправу 74 (в,г ) 75 (б,в)
25.10.2022 9-а,в,г
24.10.2022 9-б
24 .10.2022 9-д Реакції обміну між розчинами електролітів, умови їх перебігу. Йонно - молекулярні рівняння.
22.10.2022 9-б,д
Перегляньте навчальне відео і підготуйтеся до залікового уроку.
https://www.youtube.com/watch?v=hklrbfR05BM
22.10.2022 9-б
21.10.2022 9- а,в ( уроків не було ч/з тривогу)
20.10.2022 9-г,д
Тематичний контроль знань
Для тих учнів, хто навчається ДИСТАНЦІЙНО:
виконати тестову роботу за покликанням https://vseosvita.ua/test/start/hcu486
18.10.2022 9-а,б,в,г
17.10.2022 9- д,б Електролітична дисоціація Тренувальні вправи.
Лабораторний дослід №3
Домашнє завдання . Повторити § 6-8 , виконати вправи 52,61
15.10.2022 9-а,в Тестування з теми Розчини Електролітична дисоціація за покликанням
https://vseosvita.ua/test/start/cws298
14.10.2022 9-а,в
13.10.2022 9-г,д
11.10.2022 9-б
Ступінь електролітичної дисоціації. Сильні та слабкі електроліти.
Електроліти в розчинах по-різному дисоціюють на іони. Кількісною характеристикою розпаду молекул на іони є ступінь дисоціації α. У розчинах слабких електролітів ступінь дисоціації менше 3%. Електроліти середньої сили мають значення α понад 3% і менше 30%, α сильних електролітів — понад 30%.
Слабкі електроліти при розчиненні у воді практично не дисоціюють на йони. У таких електролітів ступінь дисоціації прямує до нуля.
Кількісним показником електролітичної дисоціації на йони є
ступінь дисоціації – α (альфа): 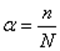
де n – кількість дисоційованих молекул на йони; N – загальна кількість молекул, що знаходяться у розчині. Ступінь дисоціації α виражається в частках одиниці, або у відсотках.
Домашнє завдання Опрацювати § 8 виконати впр.61
11.10.2022 9-а,в,г
4.10.2022 9-б https://meet.google.com/apf-jyrt-tkr
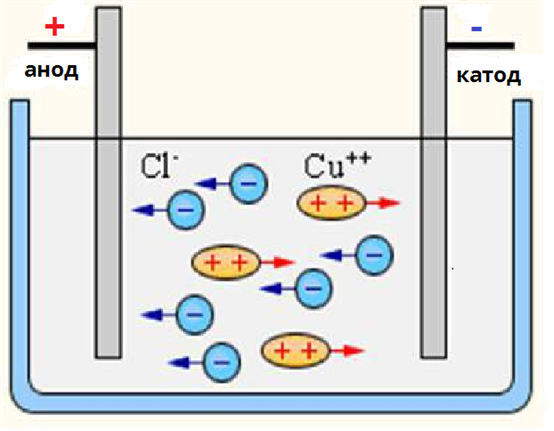
Електролітична дисоціація
https://www.youtube.com/watch?v=nkuHSio5ZvA
Найлегше дисоціюють речовини з йонним зв'язком, оскільки вони складаються вже з готових йонів.
3. Електролітична дисоціація є зворотнім процесом для слабких електролітів. Поряд з процесом дисоціації (розпаду електроліту на йони) протікає і зворотний процес — асоціація (з'єднання йонів).
4.10.2022 9-а.г,в https://meet.google.com/apf-jyrt-tkr
3.10.2022 9- б,д https://meet.google.com/dwu-ugpc-hpp
Розв'язування задач на приготування розчинів з кристалогідратів.
ст. 24 підручника
Домашнє завдання Опрацювати § 4, виконати вправу 29
30.09.2022 9-а,в https://meet.google.com/hem-mhxg-hka
29.09.2022 9-г,д https://meet.google.com/zgx-qjky-xcd
27.09.2022 9-б https://meet.google.com/hxt-osqr-bmb
Розв'язування задач на приготування розчинів з кристалогідратів.
ст. 22-23 підручника.
https://jamboard.google.com/d/1tivdVw73FxAJOUBRmhtS4V_nwSMHN1-Wno2wDUwwFa4/edit?usp=sharing
Завдання додому. Опрацювати § 4,виконати вправи 24,25.
27.09.2022 9-г,а,в https://meet.google.com/hxt-osqr-bmb
26.09.2022 9-б, д https://meet.google.com/oun-dtjm-nis
Кристалогідрати.
24.09.2022 9-а,б,в,г асинхронно
Теплові ефекти, що супроводжують розчинення речовин.
23.09.2022 9-а,б,в https://meet.google.com/mjc-cige-afq
22.09.2022 9-г, д https://meet.google.com/rir-vemt-iyq
Розчинність речовин, її залежність від різних чинників.
Розчинність - це здатність речовин розчинятися в інших речовинах.
S - розчинність
Розчинність показує найбільшу масу речовини, яка може за певних умов розчинитися в 100г розчинника.
Розчинні речовини - в 100 г розчинника може розчинитися більше 1 г речовини;
малорозчинні - в 100 г розчинника може розчинитися менше 1 г речовини;
прктично нерозчинні - в розчин переходить менше 0.01г речовини.
Чинники, що впливають на розчинність речовин:
1. природа розчинника і розчиненої речовини;
2. температура;
3. тиск (для газів).
Домашнє завдання. Опрацювати § 5, ст 31 позаурочний експеримент ( за бажанням)
20.09.2022 9-а,б,в, г https://meet.google.com/tcw-zmmc-gus
19.09.2022 9-д https://meet.google.com/tmb-bjhh-gog
Будова молекули води. Водневий показник
pH нейтрального водного розчину становить 7, розчини із більшим значенням водневого показника є лужними, із меншими — кислими.
Увага ! Тестування проходити під час уроку за розкладом!!!!
Діагностичне тестування за курс хімії 8 класу.
Для проходження тесту перейдіть за покликанням:
16.09.2022 9-в https://vseosvita.ua/test/start/bgj101
16.09.2022 9-а https://vseosvita.ua/test/start/omd393
16.09.2022 9-б https://vseosvita.ua/test/start/bkv084
15.09.2022 9-г https://vseosvita.ua/test/start/obg780
15.09.2022 9-Д https://meet.google.com/zjb-ssso-pdy
Тема. Поняття про дисперсні системи. Колоїдні та істинні розчини
Домашнє завдання. Опрацювати § 1.
14.09.2022 9-Д клас
Діагностичне тестування за курс хімії 8 класу.
Для проходження тесту перейдіть за покликанням:
https://vseosvita.ua/test/start/dyt055
13.09.2022 9-а https://meet.google.com/vax-ipvz-ngo
13.09.2022 9-б https://meet.google.com/vax-ipvz-ngo
13.09.2022 9-в https://meet.google.com/vax-ipvz-ngo
13.09.2022 9-г https://meet.google.com/vax-ipvz-ngo
13.09.2022 9-д https://meet.google.com/vax-ipvz-ngo
Тема. Повторення. Хімічний зв'язок і будова речовини.
Домашнє завдання. Повторити типи хімічних зв'язків (по презентації).
Розписати механізм утворення молекули хлору та магній броміду.
9.09.2022 9-Б https://meet.google.com/caa-tdkb-owa
Тема. Повторення. Основні класи неорганічних сполук та їхні властивості.
Тренувальний тест
https://www.iznotest.info/osnovni-klasi-neorganichnih-spoluk-oksidi-kisloti/
Домашнє завдання. Завершити проходження тесту.
8.09.2022 9-А https://meet.google.com/ddf-hzyw-psc
8.09.2022 9-Б https://meet.google.com/ddf-hzyw-psc
8.09.2022 9-В https://meet.google.com/ddf-hzyw-psc
Тема. Повторення. Основні класи неорганічних сполук та їхні властивості.
Домашнє завдання.Напишіть рівняння реакцій за поданими схемами:

06.09.2022 9-В https://meet.google.com/pmi-nycy-mjd
05.09.2022 9-Д https://meet.google.com/zug-nnff-sny
02.09.2022 9-Б https://meet.google.com/imq-uyot-jup
02.09.2022 9-В https://meet.google.com/bpp-ffdq-eho
Тема. Повторення.Основні класи неорганічних речовин, їх склад та номенклатура.








